所有生物学功能都取决于不同蛋白如何相互相互作用。蛋白质蛋白相互作用有助于从转录DNA和控制细胞分裂到复杂生物体中的高级功能。
然而,关于这些功能如何在分子水平上进行策划,以及蛋白质如何与其他蛋白质或与自身拷贝相互作用的方式尚不清楚。
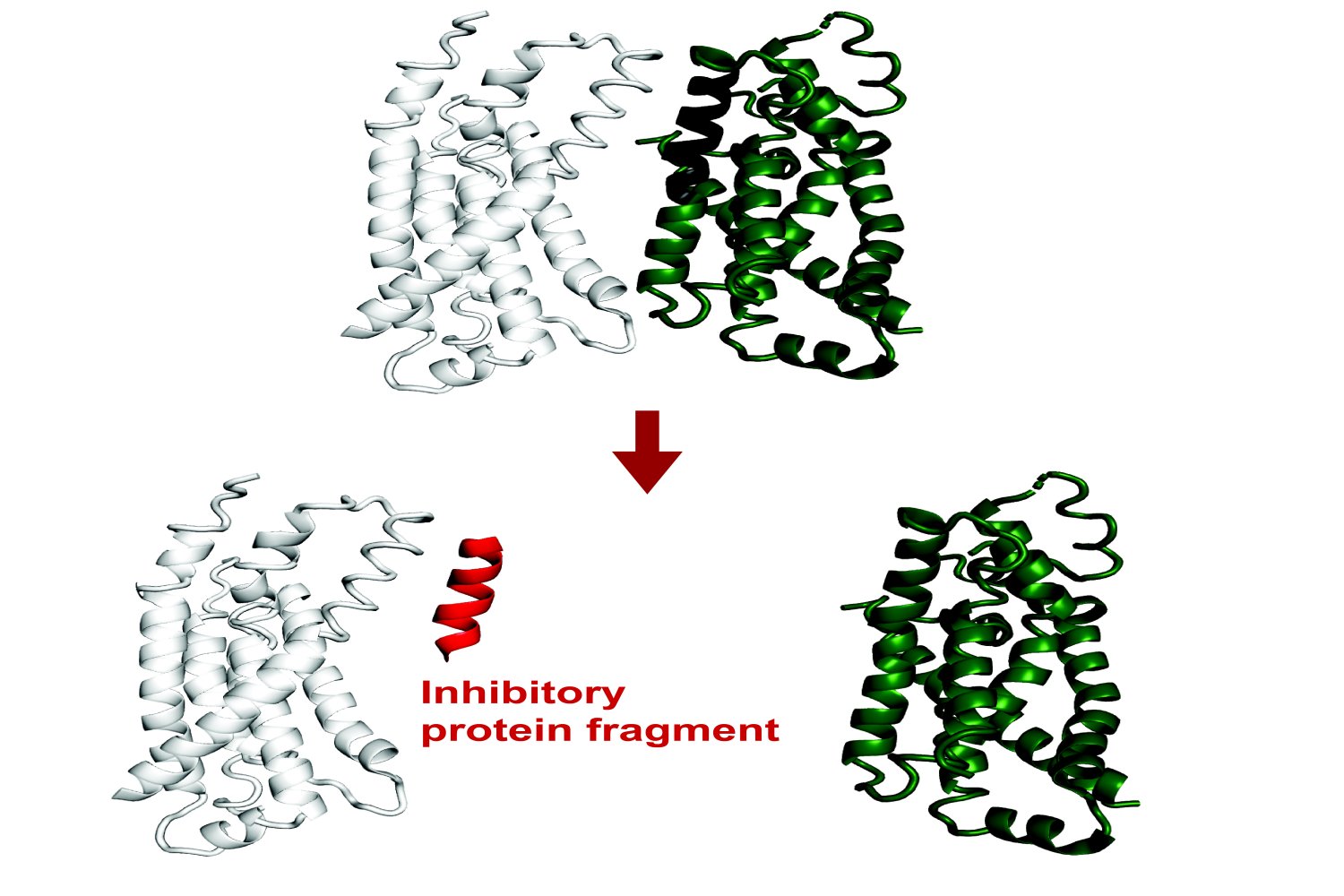
最近的发现表明,小蛋白质片段具有很大的功能潜力。即使它们是不完整的碎片,短氨基酸仍然可以与靶蛋白的界面结合,从而概括了天然相互作用。通过这个过程,它们可以改变该蛋白质的功能或破坏其与其他蛋白质的相互作用。
因此,蛋白质片段可以增强对蛋白质相互作用和细胞过程的基础研究,并可能具有治疗性应用。
最近发表在 国家科学院论文集,生物学系开发的一种新方法是建立在现有的人工智能模型的基础上,以预测可以结合并抑制全长蛋白质的蛋白质片段 大肠杆菌。从理论上讲,该工具可能导致对任何蛋白质的遗传编码抑制剂。
这项工作是在生物学副教授和霍华德·休斯医学研究所研究员的实验室中完成的Gene-wei li与Jay A. Stein(1968)生物学教授,生物工程教授和系主任的实验室合作艾米·基廷(Amy Keating)。
利用机器学习
该程序称为Fragfold,利用Alphafold,这是一种AI模型,该模型由于预测蛋白质折叠和蛋白质相互作用的能力而导致生物学的显着发展。
该项目的目的是预测碎片抑制剂,这是Alphafold的新应用。该项目的研究人员在实验上证实,即使研究人员以前没有关于这些相互作用机制的结构数据,fragfold的一半以上的碎片预测也是准确的。
我们的结果表明,这是一种可概括的方法,可以找到可能抑制蛋白质功能的结合模式,包括用于新的蛋白质靶标,您可以将这些预测用作进一步实验的起点。”首先是对应的作者安德鲁·萨维诺夫(Andrew Savinov),李实验室的博士后。•我们可以真正将其应用于没有已知功能的没有已知相互作用的没有已知结构的情况下,甚至没有已知结构,我们可以在这些模型中提供一些信任。”
一个例子是FTSZ,这是一种蛋白质,是细胞分裂的关键。它是经过充分研究的,但包含一个本质上无序的区域,因此尤其具有挑战性。无序的蛋白质是动态的,其功能相互作用很可能是短暂地发生的,以至于当前的结构生物学工具可以捕获单个结构或相互作用。
研究人员利用碎片来探索FTSZ碎片的活性,包括本质上无序区域的片段,以识别与各种蛋白质的几种新结合相互作用。这种理解的飞跃证实并扩展了以前测量FTSZ生物学活性的实验。
这种进展很重要,部分原因是它是在不解决无序区域结构的情况下进行的,并且因为它表现出碎片的潜在力量。
基廷说,这是Alphafold如何改变我们如何研究分子和细胞生物学的一个例子。”AI方法的创造性应用,例如我们在Fragfold上的工作,打开意想不到的能力和新的研究方向。”
抑制,及以后
研究人员通过计算分裂每种蛋白质,然后建模这些碎片将如何与他们认为相关的相互作用伙伴结合,从而实现了这些预测。
他们使用高通量实验测量结果确定了整个序列中预测结合的图与这些相同片段的作用,其中数百万个细胞会产生一种类型的蛋白质片段。
Alphafold使用共进化信息来预测折叠,通常使用每种预测运行的一种称为多个序列比对的东西评估蛋白质的进化历史。MSA是至关重要的,但是大规模预测的瓶颈 - 它们可以花费大量的时间和计算能力。
对于Fragfold而言,研究人员曾经将MSA预先计算为全长蛋白,并使用该结果指导该全长蛋白的每个片段的预测。
Savinov与Keating Lab校友Sebastian Swanson Phd 23一起预测了除FTSZ外,除了FTSZ之外,还预测了多种蛋白质的抑制片段。他们探索的相互作用中有脂多糖转运蛋白LPTF和LPTG之间的复杂性。LPTG的蛋白质片段抑制了这种相互作用,大概破坏了脂多糖的递送,这是脂多糖的递送 大肠杆菌 - 外细胞膜对于细胞适应性必不可少。
萨维诺夫说,最大的惊喜是我们可以以如此高的精度预测约束,实际上通常可以预测与抑制相对应的绑定。”对于我们看的每种蛋白质,我们都可以找到抑制剂。
研究人员最初以蛋白质片段为抑制剂,因为片段是否可以阻止细胞中的基本功能是一个相对简单的结果。它们结合,增强或改变其功能或触发蛋白质降解的蛋白质。
设计原则
这项研究是建立对细胞设计原理的系统性理解的起点,哪些元素可能会借鉴哪些元素来进行准确的预测。
萨维诺夫说:``萨维诺夫说。现在,我们可以预测它们,我们可以使用预测和实验中拥有的数据来拔出显着特征,以找出Alphafold实际上已经了解了什么使良好抑制剂的原因?
Savinov和合作者还进一步研究了蛋白质碎片如何结合,探索其他蛋白质相互作用并突变特定残基,以了解这些相互作用如何改变片段与靶标相互作用的方式。
通过实验检查细胞内数千个突变片段的行为,一种称为深突变扫描的方法,发现了负责抑制的关键氨基酸。在某些情况下,突变的片段比其自然的全长序列更有效抑制剂。
Swanson说,与以前的方法不同,我们不仅限于确定实验结构数据中的碎片。这项工作的核心强度是高通量实验抑制数据与预测的结构模型之间的相互作用:实验数据指导我们走向特别有趣的片段,而fragfold预测的结构模型则提供了特定的,可测试的。假设碎片在分子水平上的作用。
萨维诺夫(Savinov)对这种方法的未来及其无数应用感到兴奋。
li表示同意,通过创建紧凑的,遗传编码的粘合剂,Fragfold打开了操纵蛋白质功能的广泛可能性。我们可以想象,提供功能化的片段,可以改变天然蛋白质,改变其亚细胞定位,甚至重新编程,以创建用于研究细胞生物学和治疗疾病的新工具。”